Z przyjemnością przedstawiamy półroczne podsumowanie postępu prac w projekcie „Opracowanie produktu leczniczego opartego o modyfikowane genetycznie limfocyty T dla terapii nawrotowych i opornych postaci szpiczaka plazmocytowego: od produkcji wektora DNA z receptorem CAR po badania I/II fazy”. Okres ten obfitował w osiągnięcia, które przybliżają nas do rozpoczęcia badań klinicznych.

Intensywnie pracujemy nad rozwijaniem naszej terapii, skupiając się na jej efektywności i bezpieczeństwie. Zgodnie z opinią Europejskiej Agencji Leków (EMA) klasyfikujemy badany produkt do kategorii GTMP (Advanced Therapy Medicinal Products). Najnowsze dane literaturowe wskazały na potrzebę rozszerzenia linii leczenia CAR-T i wprowadzenia dodatkowego celu terapeutycznego. W odpowiedzi na to nasz zespół badawczy opracował innowacyjne konstrukty bispecyficzne CAR-T, co może przezwyciężyć ograniczenia terapii opartej na pojedynczym antygenie, zwiększając jej potencjalną skuteczność.
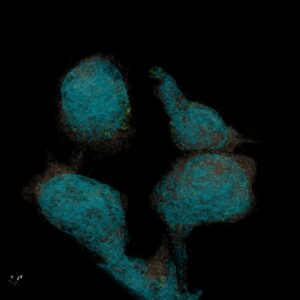
Nasze prace laboratoryjne koncentrowały się na optymalizacji procesów produkcyjnych i badaniach funkcjonalnych. Przeprowadziliśmy modelowanie białka CAR-T oraz dokowanie antygenów. Dodatkowo zoptymalizowaliśmy proces produkcji wektorów lentiwirusowych, co ma kluczowe znaczenie dla wytwarzania materiału do terapii. Opracowaliśmy i znacząco rozszerzyliśmy działania nad zoptymalizowanym protokołem produkcji limfocytów CAR-T, co pozwala na uzyskanie wysokiej jakości produktu. Przeprowadzone testy in vitro wykazały, że otrzymane transduktanty CAR-T działały specyficznie względem komórek szpiczaka mnogiego. Potwierdzono ich proliferację, aktywność cytotoksyczną oraz produkcję cytokin, co świadczy o ich potencjale terapeutycznym. Obecnie trwają prace nad przygotowaniem badań in vivo na modelach mysich, które pozwolą na dalszą walidację.
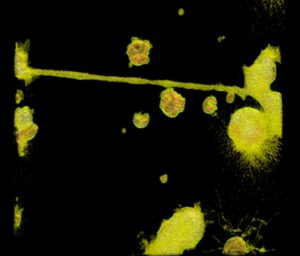
Aktywnie przygotowujemy się do etapu klinicznego projektu. Kontynuujemy przygotowywanie dokumentacji badania klinicznego, co jest niezbędne do uzyskania zgód na jego rozpoczęcie. Rozpoczęto także prace nad budową pracowni GMP (Good Manufacturing Practice) do produkcji lentiwirusów. Jest to kluczowy element, który zapewni wysoką jakość i bezpieczeństwo produktu końcowego.
Realizacja części klinicznej projektu została zaplanowana na luty 2026 roku. Nasz projekt jest realizowany zgodnie z założeniami i z optymizmem patrzymy na kolejne etapy.

